11月20号,国际细胞生物学权威期刊《The Journal of Cell Biology》(5年影响因子9.306)以Article形式在线发表了基础医学院生物化学及分子生物学系季维克副教授的最新研究成果,论文题目为 “受体介导线粒体分裂蛋白Drp1在内质网上的寡聚合”(Receptor mediated Drp1 oligomerization on Endoplasmic reticulum)。季维克为第一作者,基础医学院为现工作单位。
线粒体作为细胞内能量、代谢与信号转导的枢纽,时刻进行着分裂与融合。线粒体分裂与融合是高度调控的动态过程,是线粒体质量控制与转运的基础。线粒体分裂的调控机制是近年来的研究热点。最近的研究表明,内质网小管通过与线粒体形成接触位点(contact site),促进线粒体特异性地在内质网-线粒体接触位点处分裂 (Friedman (2011) Science)。 但迄今为止,内质网介导线粒体分裂的作用机制仍然未知。
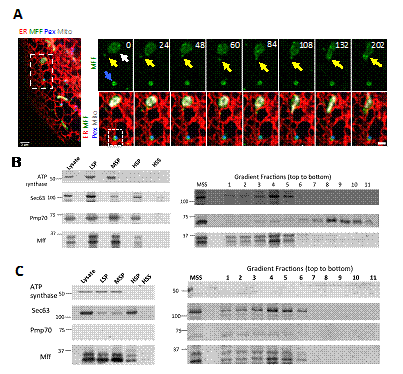
Drp1是负责线粒体分裂的核心蛋白,主要以单体或二聚体形式存在于细胞质,通过与线粒体外膜上的Drp1受体结合,招募到线粒体上,寡聚合之后介导线粒体分裂。在该研究中,季维克所在团队采用Crispr-cas9基因敲入的办法,将GFP加入到细胞基因组Drp1基因的上游,从而构建了GFP标记内源性Drp1的细胞系。通过高分辨率活细胞成像发现,Drp1单体不仅存在于线粒体和过氧化物酶体(已有文献报到),而且有一部分位于内质网。定位于内质网上的Drp1与内质网上的Drp1受体Mff相互作用,Mff促进Drp1在内质网上的招募和寡聚合。同时,他们发现定位于内质网上的Drp1单体可以沿着内质网小管移动,并通过内质网与线粒体接触位点,招募到到线粒体外膜上,进一步参与线粒体的分裂。利用Rapamycin诱导技术,他们证实特异性地敲除定位于内质网上的Mff显著地抑制线粒体的分裂。
 学院官方微信
学院官方微信