2023年1月20日,Signal Transduction and Targeted Therapy杂志在线发表基础医学院黄波教授团队最新研究论文“Chemo-drugs in cell microparticles reset antitumor activity of macrophages by activating lysosomal P450 and nuclear hnRNPA2B1”,揭示载药囊泡将癌性胸水中促肿瘤M2型肿瘤相关巨噬细胞逆转为抗肿瘤M1型巨噬细胞,更进一步阐释载药囊泡作为新型抗肿瘤免疫治疗技术的基本原理。
囊泡(Microparticles)是细胞骨架发生改变,由细胞膜包裹细胞内容物以“出芽”的方式释放到细胞外、大小介于100~1000纳米的亚细胞结构。利用囊泡的载体特征,黄波研究团队10年前即自主成功研发出“载药囊泡治疗肿瘤技术”,现已在湖北、河南、安徽、山东、天津等多省市获批临床应用,治疗癌性胸腹水和肝门外梗阻性胆管癌。该技术对于临床非常棘手的恶性积液具有奇特效果,不仅能够有效的杀伤耐药性的肿瘤种子细胞,而且还可以激活抗肿瘤巨噬细胞并招募大量中性粒细胞,最终使得癌性积液,特别是恶性胸水能够得到控制。尽管如此,该过程中载药囊泡激活抗肿瘤巨噬细胞这一关键事件,其背后机制尚未解析。
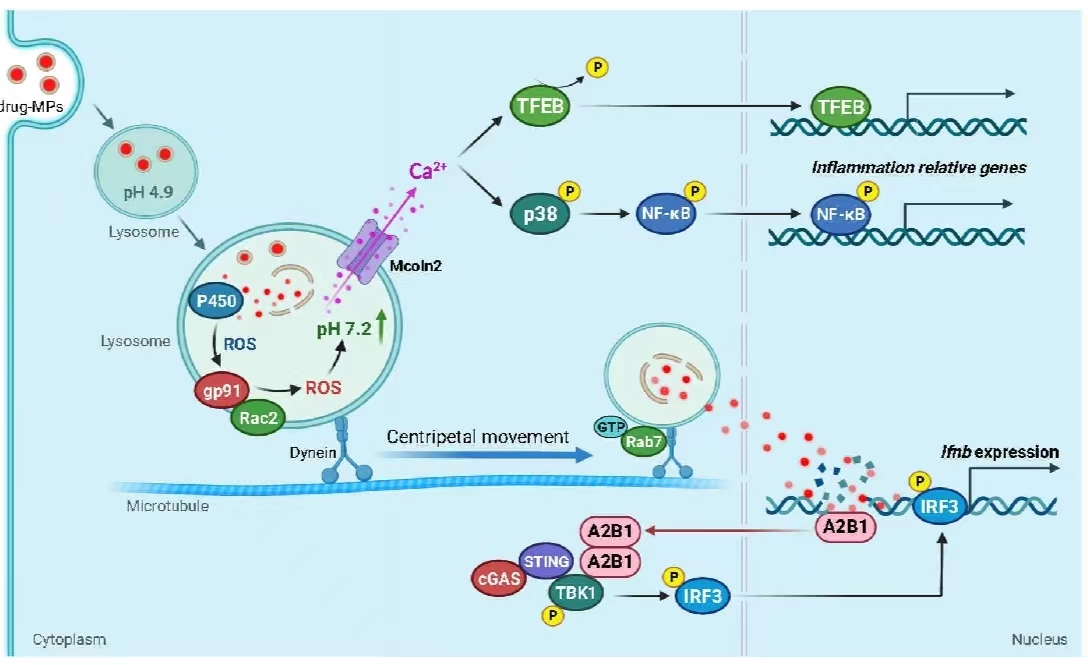
恶性积液中通常出现巨噬细胞聚积,其表现为促肿瘤M2型。在这项研究中,研究团队发现载药囊泡可将促肿瘤M2型肿瘤相关巨噬细胞逆转为抗肿瘤M1型巨噬细胞并伴随IFN-β释放。机制上,载药囊泡被巨噬细胞摄取进入溶酶体,激活溶酶体内P450单加氧酶系统,产生超氧阴离子,后者进一步激活NOX2氧化系统,放大ROS产生,导致溶酶体pH升高。升高的pH不但触发溶酶体内Ca2+释放,促进转录因子TFEB入核,上调M1型相关炎性基因的表达,而且通过募集马达蛋白Dynein,驱动溶酶体沿微管向细胞核移动,进而将药物分子递送至细胞核内以激活核DNA感受器hnRNPA2B1,激发IFN-β生成信号。这一关键机制的阐明,对于载药囊泡治疗临床恶性胸腹水具有重要意义,且为载药囊泡和PD-1抗体的联合治疗提供了理论基础。
本研究工作得到了国家自然科学基金、中国医学科学院医学与健康科技创新工程项目、细胞生态系统创新基金海河实验室项目的支持。Signal Transduction and Targeted Therapy杂志最新影响因子为38.104,免疫学系位珂珂博士后和病理学系张华锋副教授为本论文的共同第一作者,黄波教授和免疫学系马婧薇副教授为该文共同通讯作者。
相关论文信息(DOI):https://www.nature.com/articles/s41392-022-01212-7#Sec2
 学院官方微信
学院官方微信