
2023年3月22日,国际著名学术期刊《自然》(Nature)在线发表了华中科技大学基础医学院、细胞架构研究中心于洪军、张敏团队与南方科技大学刘晓天团队合作的研究论文,题为《真菌β-1,3-葡聚糖合成酶FKS1的分子机理》(Structural and mechanistic insights into fungal β-1,3-glucan synthase FKS1),华中科技大学基础医学院为论文的第一完成单位。该研究解开了困扰领域多年的抗真菌药物重要靶点-真菌细胞壁β-1,3-葡聚糖的合成及其靶向药物的作用机制之谜,对于应对侵袭性真菌感染这一临床问题具有重要科学意义。

侵袭性真菌感染每年造成超过150万人的死亡,好发于免疫缺陷、器官移植、重症新冠肺炎等高危人群,患者病死率极高。这一严重疾病的治疗却面临药物种类极为有限、药物毒副作用大、耐药性菌株不断出现等严峻问题,因此,迫切需要开发多种新型抗真菌药物以应对当前需求。β-1,3-葡聚糖是真菌细胞壁特有的核心多糖成分,其合成途径是开发抗真菌药物的关键靶点,成功的靶向药物包括临床上广泛使用的棘白菌素类一线药物以及近期获批的新药艾瑞芬净(ibrexafungerp)和瑞扎芬净(rezafungin)。然而,长期以来,对真菌细胞壁β-1,3-葡聚糖的合成机制缺乏了解,是领域内面临的瓶颈问题。虽然一些间接证据提示了FKS1是可能的葡聚糖合成酶,但至今仍缺乏二者联系的直接证据。另外,棘白菌素类药物的抗真菌机制是什么?广泛出现的耐药性来源是什么?这一系列与临床紧密联系的关键问题仍不清楚,严重阻碍了该领域新药创制的发展。
针对上述问题,研究团队通过生物化学分析和探索性功能实验,巧妙的设计并筛选到了影响FKS1活性的重要突变,建立了关键的提纯和反应条件,并对体外聚合产物应用糖苷酶水解、薄层层析、甲基化色谱质谱分析等手段进行多角度分析,首次直接证明了FKS1可以特异性合成真菌细胞壁β-1,3-葡聚糖,解决了领域内的关键问题(图1a-d)。研究人员据此建立了FKS1活性的非放射性检测体系,有助于建立简易、高效的药物筛选体系,具有非常重要的应用价值。研究人员还鉴定出了FKS1的两个关键功能区域,包括一个近细胞膜的催化反应中心和一个半闭合的聚糖跨膜转运通道。通过系统性突变研究以及体内、体外的功能分析,确定了FKS1合成β-1,3-葡聚糖的催化和转运机制,在多种致病真菌中高度保守,对于广谱抗真菌药物的开发具有非常重要的意义(图1e)。为了探索靶向药物的作用机制,研究人员通过生化分析揭示了耐药相关热点区域的空间分布和特点:位于紧邻的三股跨膜螺旋TM5-6和TM8上,并结合有多个高度有序的脂分子,形成潜在的药物结合位点(图1g)。药物活性实验证实了这些位点的突变会显著降低FKS1对药物的敏感性,进而产生耐药性(图1f)。研究人员最终解析了临床上最常见的代表性耐药突变体FKS1-S643P的蛋白构象,比对分析发现了该突变引发了耐药热点区域的显著构象变化,并导致了附近脂分子的重排(图1h),揭示了耐药性产生的一种独特分子机理,为解决临床耐药问题提供了重要启示。
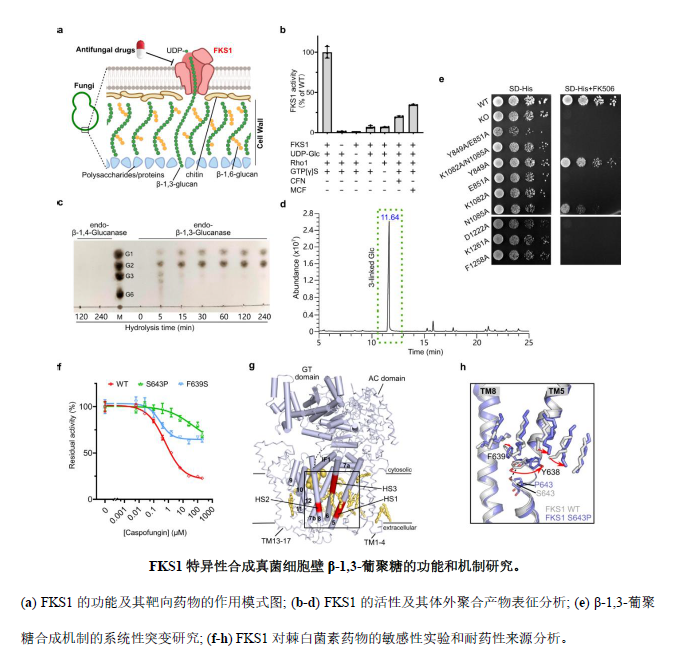
综上所述,该研究工作突破性的解决了抗真菌药物开发领域的关键问题-真菌细胞壁β-1,3-葡聚糖合成的分子机制,揭示了棘白菌素类一线抗真菌药物的作用机制和耐药产生机理,研究成果不仅有助于应对日益严峻的真菌耐药问题,也会有力推进新型抗真菌药物的开发进程,对于解决侵袭性真菌感染这一重大临床问题至关重要。
论文第一完成单位为华中科技大学基础医学院,生物化学与分子生物学系于洪军教授、病原生物学系张敏副研究员和南方科技大学刘晓天副研究员为本文的共同通讯作者,基础医学院博士生胡鑫霖、杨坪为共同第一作者,硕士生柴长栋、博士生刘佳、孙欢欢、吴亚楠在研究中做出了贡献。该研究工作得到了国家自然科学基金面上项目、青年项目、重大研究计划(培育项目)等项目的资助以及华中科技大学基础医学院、细胞架构研究中心和南方科技大学张明杰院士团队的大力支持。

该论文是基础医学院于洪军、张敏团队在继“抗真菌药物尼克霉素Z抑制真菌细胞壁几丁质合成的分子机制研究”(Structures and mechanism of chitin synthase and its inhibition by antifungal drug Nikkomycin Z,详见http://www.tjmu.edu.cn/info/1051/11672.htm)2022年12月发表于Cell Discovery之后,基于在糖生物学领域积累的研究基础,聚焦抗真菌药物靶点领域的又一项进展。该团队长期从事疾病相关蛋白复合物的机制研究,特别关注真核生物糖基化的分子机制、靶向干预及其在疾病中的应用,相关研究成果在Nature、Cell、Nature Chemical Biology、PNAS、Nature Communications、Cell Reports、Cell Discovery等国际知名期刊发表论文多篇。
《自然》(Nature)是世界上历史悠久的、最有名望的科学杂志之一,首版于1869年11月4日,负责报道和评论全球科技领域里最重要的突破。
 学院官方微信
学院官方微信