肝细胞癌(hepatocellular carcinoma ,HCC)是最常见的原发性肝癌,通常由慢性肝病发展而来,其死亡率位列全球因癌症所致死亡的第三位。大多数肝癌患者发现肿瘤时已进入中晚期,肝脏已形成多个结节性肿瘤,肿瘤侵袭血管或发生肝外播散,导致患者的生存率低。近年来,尽管针对晚期肝癌的治疗不断提出了各种策略,但对改善患者的生存率和预后的作用差强人意。血小板在肿瘤发生发展中的作用以及对肿瘤患者的预后的影响逐渐成为关注热点。肿瘤的转移是导致患者低生存率的主要因素,血小板主要通过两种方式促进肿瘤的转移。当肿瘤细胞从原发病灶脱离进入血液循环与血小板相遇,一方面肿瘤细胞能激活血小板使其释放颗粒内容物,从而参与肿瘤发生发展;另一方面血小板与肿瘤细胞直接接触,包被在肿瘤细胞表面,形成保护罩,避免免疫细胞的杀伤而形成转移。目前,关于血小板是否以及如何调控肝癌转移的研究尚少,除上述机制外是否有其他途径影响肝癌的转移,这些问题的回答有望开辟肝癌防治的新途径,找到肝癌治疗的新靶点。
2024年2月10日,华中科技大学同济医学院基础医学院药理学系明章银教授团队在国际权威期刊Cancer Letters上在线发表了题为“Direct interaction of platelet with tumor cell aggravates hepatocellular carcinoma metastasis by activating TLR4/ADAM10/CX3CL1 axis”的研究论文,揭示了血小板和肝癌细胞直接作用激活TLR4/NF-κB信号上调ADAM10表达,通过CX3CL1/CX3CR1通路促进肝癌的转移。

本研究发现血小板激活肝癌细胞TLR4/NF-κB信号上调ADAM10表达。ADAM10 增加CX3CL1的胞外域剪切,脱落的CX3CL1结合CX3CR1,促进上皮间质化和RhoA信号活化,增强肝癌细胞的迁移和侵袭。此外,血小板激活TLR4/ADAM10/CX3CL1轴增加血管内皮通透性,帮助肝癌细胞通过血管屏障。因此,靶向TLR4/ADAM10/CX3CL1轴有望成为抑制血小板介导肝癌转移的潜在途径。
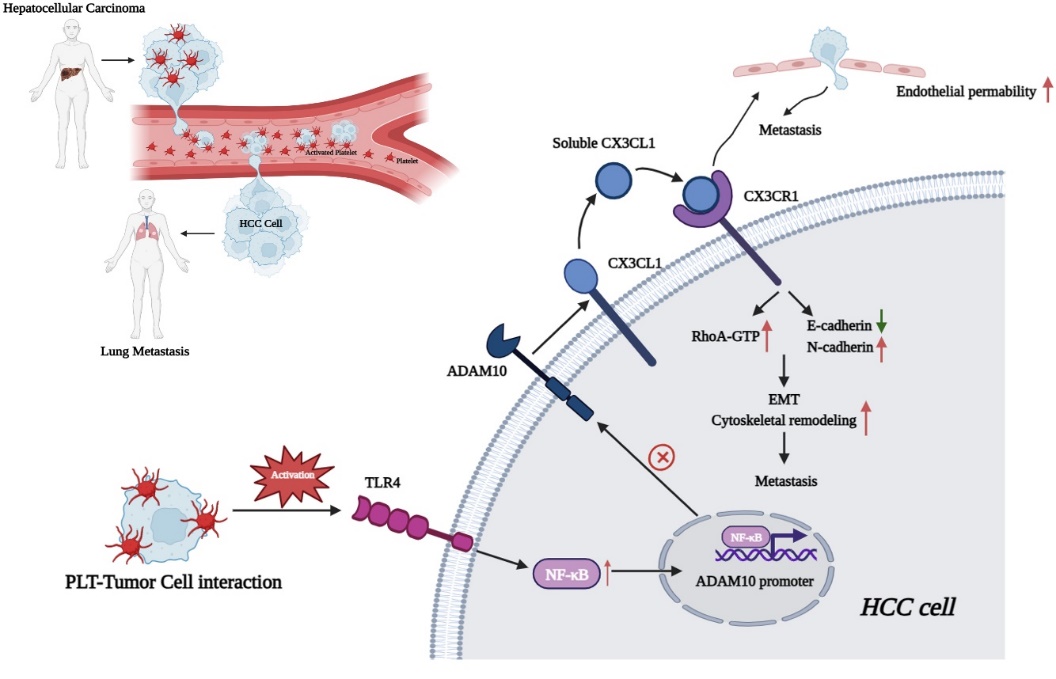
图:血小板激活肝癌细胞TLR4/ADAM10/CX3CL1轴促肝癌转移的模式图
同济医学院基础医学院药理学系博士生高嘉慧为该论文的第一作者,明章银教授为通讯作者,附属同济医院肝脏外科的张必翔教授、梁慧芳教授为本研究提供了重要支持和指导,已毕业博士生湖北中医药大学周雅君副教授和我校何奥迪讲师以及伦敦玛丽女王大学的吕永杰教授参与本研究工作。该研究得到国家自然科学基金面上项目和华中科技大学创新研究院研究生创新基金的资助。明章银教授团队多年来致力于探索血小板在肿瘤和心血管等疾病发生发展中的作用及调控机制,期望为临床疾病的防治提供新的思路。
原文链接:https://doi.org/10.1016/j.canlet.2024.216674
 学院官方微信
学院官方微信