阿尔茨海默病(AD)是最为常见的神经退行性疾病。在AD早期,患者脑内出现葡萄糖代谢障碍,但其作用及分子机制尚不清楚。2024年4月29日,华中科技大学同济医学院基础医学院的王建枝/杨莹教授团队在Signal Transduction and Targeted Therapy上发表了题为“A positive feedback inhibition of isocitrate dehydrogenase 3β on paired-box gene 6 promotes Alzheimer-like pathology”的文章,数据表明,氧化磷酸化受损会通过IDH3β-乳酸-PAX6-IDH3β的正反馈抑制环路加速AD的进展。通过上调IDH3β或下调PAX6来打破这一循环,可减轻AD的神经变性和认知障碍。

该团队首先检测到AD 大脑的和AD转基因小鼠脑中 IDH3β 信号明显降低。为了研究 IDH3β水平降低对能量代谢的影响,该团队敲低了 IDH3β的表达。结果显示IDH3β 蛋白水平和酶活性都显著降低的同时,TCA 循环的中间产物和ATP 的产生有所减少。为了研究IDH3β减少对AD病程的影响,该团队构建了IDH3β敲除小鼠(IDH3βKD),并检测了tau病理学和突触蛋白的变化。IDH3β敲除的小鼠脑内tau磷酸化水平和寡聚化水平明显升高,突触相关蛋白Syp和PSD95水平降低。研究结果表明,抑制IDH3β会导致AD样病变。为了检测敲低IDH3β对小鼠认知能力的影响,该团队进行了一系列行为测试,结果显示敲除IDH3β损伤小鼠空间学习和记忆能力。
为了探索 IDH3β下调对乳酸生成和乳酸非代谢功能的影响,该团队检测了 IDH3β下调后乳酸和蛋白质乳酸化的水平。结果显示,下调 IDH3β导致 L-乳酸水平和整个蛋白质的乳酸化水平显著上升。为了探讨组蛋白乳酸化对IDH3β转录水平的调控,该团队检测了IDH3β转录因子的变化。根据公共数据库,PAX6、MZF1、ZBTB6、NHLH1、ZEB1 和 NR3C1 被确定为 IDH3β基因启动子中起主要调控作用的转录因子。下调 IDH3β后PAX6 蛋白水平升高,而其他转录因子的水平没有差异。这些数据共同表明,下调 IDH3β会通过乳酸的升高提升组蛋白乳酸化水平,从进而促进 PAX6 转录因子的表达。
通过公共数据库分析,该团队发现 PAX6 在 IDH3β基因启动子区域结合序列,该团队通过 ChIP 检测和 RT-PCR证实了 PAX6 与 IDH3β的直接结合。已知 PAX6 同时具有转录激活和抑制功能。该团队又通过荧光素酶报告基因实验确定PAX6 通过与 IDH3β基因启动子中的结合序列结合来抑制 IDH3β的表达。以上结果表明,IDH3β表达减少可增加组蛋白乳酸化,促进PAX6的表达,PAX6 升高升高后,又会通过正反馈调节加剧 IDH3β的减少。
最后,该团队通过上调IDH3β或者下调PAX6发现能够改善5xFAD病理损伤和代谢异常。
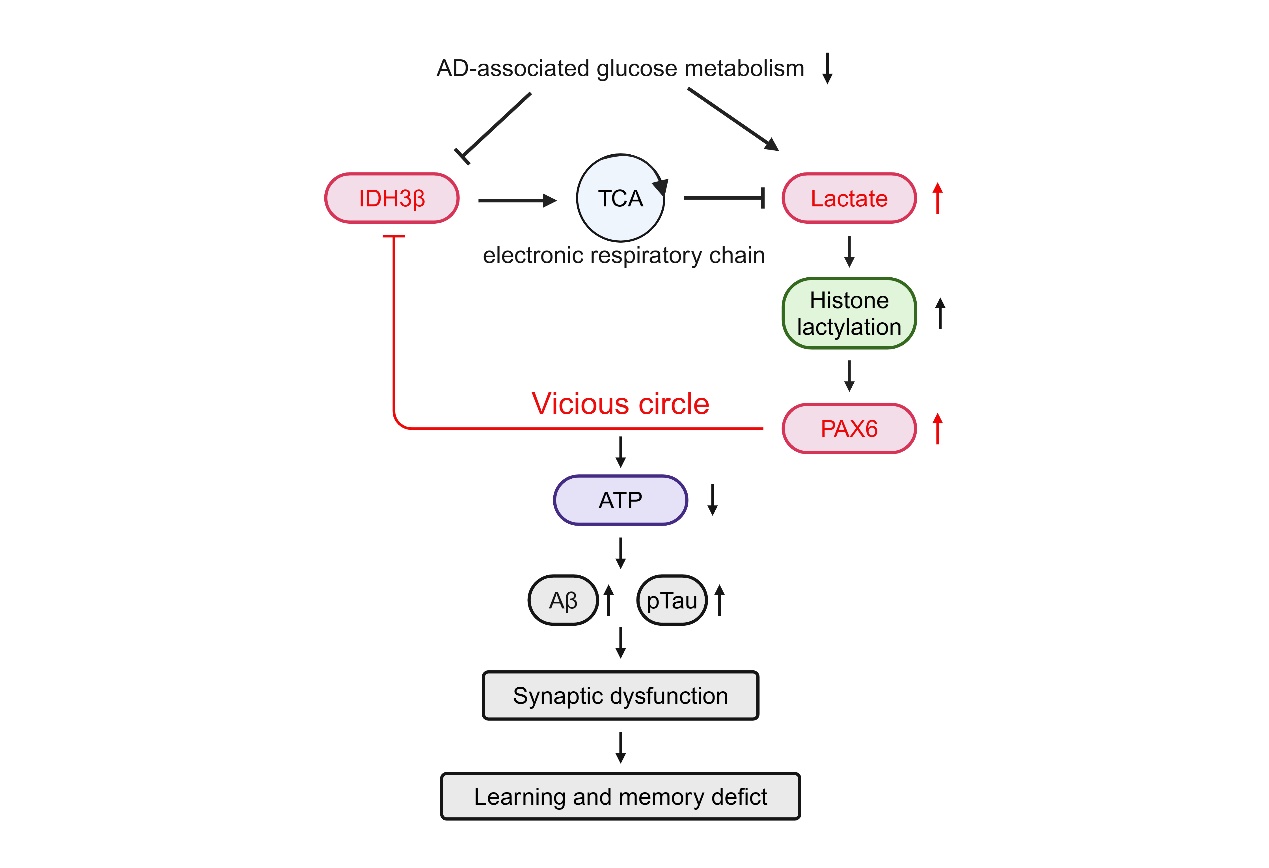
该团队通过调控IDH3β表达,阐明氧化磷酸化受损会通过IDH3β-乳酸-PAX6-IDH3β的正反馈抑制环路加速AD病程进展。上调IDH3β或下调PAX6可以打破这一循环,减轻AD的神经变性和认知障碍,为AD治疗提供新的治疗靶点。
本项研究由华中科技大学同济医学院基础医学院王建枝教授、杨莹教授、张瑶老师指导完成。华中科技大学同济医学院基础医学院博士后王鑫,博士刘倩,余海涛为共同第一作者。该研究得到了国家自然科学基金、创新研究基金的大力支持。
 学院官方微信
学院官方微信