
2024年5月14日,华中科技大学同济医学院基础医学院遗传系杨振华教授团队在国际权威期刊Cancer letters发表了题为“PARP1 interacts with WDR5 to enhance target gene recognition and facilitate tumorigenesis”的研究论文,揭示了PARP1和表观遗传调节因子WDR5在靶基因识别、基因转录调控及肿瘤发生过程中的作用机理。
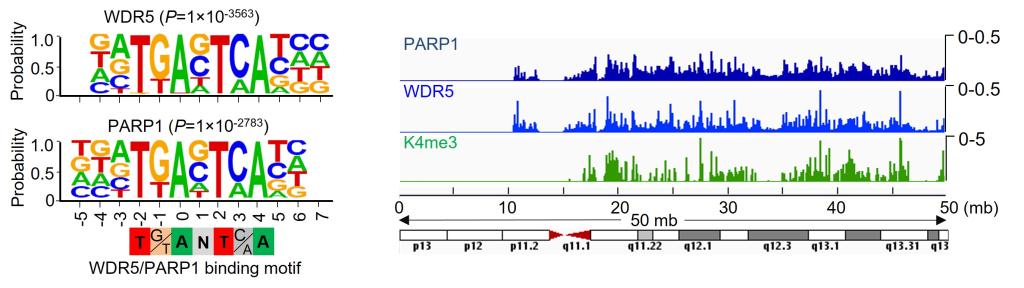
聚腺苷二磷酸核糖聚合酶1(PARP1)是PARP家族中一种最丰富的多功能蛋白质翻译后修饰酶,在DNA损伤修复中发挥重要作用,也称为DNA修复酶。针对PARP1开发的靶向抑制剂如Olaparib等已经用于临床治疗BRCA1/2基因突变的卵巢癌和乳腺癌患者(合成致死效应)。近些年来,PARP1调控基因转录的功能逐渐浮出水面,但是作用机理一直不清晰。组蛋白表观修饰对基因转录调控以及染色质结构重塑至关重要。哺乳动物细胞中,SET1/MLL家族蛋白复合物是负责组蛋白H3K4甲基化修饰的主要组分,该复合物由催化亚基(MLL1、MLL2、MLL3、MLL4、SET1A和SET1B)和核心亚基(WDR5、RBBP5、ASH2L和DPY30,简称WRAD)组成,核心亚基对催化亚基的甲基转移酶活性具有重要促进作用。课题组发现PARP1通过直接结合WDR5与SET1/MLL家族蛋白形成复合物,并且通过ChIP和CUT&Tag 测序技术发现PARP1与WDR5在染色质存在广泛共定位,但是二者和H3K4me3的定位又存在差异。敲除或敲减实验发现PARP1能够影响WDR5对一些靶基因的结合及H3K4me3水平, 而WDR5则显著促进PARP1识别靶基因位点。进一步发现WDR5 Win位点抑制剂如OICR-9429等能够阻止PARP1结合WDR5,并影响PARP1结合靶基因,重新定义了WDR5 Win 位点抑制剂的新功能。基于上述研究,课题组推测同时靶向PARP1酶活性(Olaparib)和转录功能(OICR-9429)将更显著抑制肿瘤增殖。实验证明二者联合用药更有效抑制肿瘤生长,且对小鼠没有明显的肝肾毒性。该项研究揭示了PARP1识别和调控靶基因的机制,为肿瘤的靶向治疗提供了新的策略。
基础医学院博士研究生秦亚丽为该论文第一作者,遗传系杨振华教授与病理生理系屈静教授为通讯作者,附属协和医院董小川医师参与本研究工作。该研究获得基金委面上项目、湖北省杰出青年基金等项目支持。杨振华教授团队多年来致力于探索表观遗传修饰调控肿瘤发生发展的分子机理,期望为肿瘤靶向治疗提供新的思路。
原文链接:https://www.sciencedirect.com/science/article/pii/S0304383524003458?dgcid=author
 学院官方微信
学院官方微信