
10月2号,华中科技大学基础医学院/人畜共患传染病重症诊治全国重点实验室季维克课题组在Journal of Cell Biology在线发表了题为“Sec23IP recruits VPS13B/COH1 to ER exit site-Golgi interface for tubular ERGIC formation”的研究论文。在此项工作中,研究团队鉴定了ER exit site相关蛋白Sec23IP作为VPS13B的招募因子。Sec23IP将VPS13B招募至ER exit site-Golgi 互作界面。尽管先前研究已明确VPS13B 和 Sec23IP 在精子顶体生物发生的关键作用,但二者物理的相互作用尚未有报道。这一发现揭示VPS13B在ER-to-Golgi早期分泌阶段的关键作用,同时提示早期分泌异常是导致Cohen 综合征发病和精子顶体发生异常的共同因素。
真核细胞的生命过程依赖于特化的细胞器。不同细胞器在功能上分工明确,但同时需要密切协作,形成细胞器互作网络。细胞器之间可通过物理接触(膜接触),实现快速的物质交换和信息交流,高效执行各项生物学功能,维持细胞及机体的功能稳态。转脂蛋白在这些膜接触位点发挥关键作用。转脂蛋白特异性富集在膜接触通过介导细胞器间膜脂交换,调控细胞器的发生、降解及动态。
VPS13B 是新型转脂蛋白家族的成员。人类基因组包含四个 VPS13 基因(VPS13A-D),这些基因与多种疾病直接相关,因此这些蛋白具有重要的研究意义,成为学界研究的热点。研究表明,VPS13A、VPS13C和VPS13D是内质网相关膜接触(MCS)的转脂蛋白,包括内质网线粒体/质膜(VPS13A)和内质网晚期内吞体/溶酶体MCS(VPS13C)。VPS13D 在果蝇线粒体自噬中发挥作用,并定位于内质网-线粒体/过氧化物酶体接触。饥饿时VPS13D与ESCRT蛋白TSG101协作调控脂滴重塑。
Cohen综合征是一种罕见的常染色体隐性遗传性发育障碍。其临床表现多样,主要特征包括发育迟缓、智力迟钝、关节松弛、小头畸形、典型面部畸形、进行性色素性视网膜病变、严重近视和间歇性中性粒细胞减少症。VPS13B基因功能缺失突变是Cohen综合征唯一已知的致病因素,但其致病的细胞生物学机制尚不清楚。尽管VPS13B 已被证明在多个细胞过程中发挥重要作用,例如高尔基体完整性和神经突生长、货物回收运输、顶体生物发生和脂滴动态调控等,但迄今为止,相较于其他VPS13蛋白,学界对VPS13B的理解仍处于初级的功能描述阶段,VPS13B是否与MCS相关以及VPS13B功能缺失致病的潜在机制未知,是学界亟待解答的关键科学问题。
研究团队深入探讨了Sec23IP与VPS13B互作的分子机制,发现VPS13B的VAB (VPS13 adaptor binding) domain负责与Sec23IP N-terminal disorder区域结合。这一发现与之前学界认可的VPS13蛋白与其招募因子结合的模式一致。重要的是,研究人员通过成像和生化实验阐明Cohen 综合征相关的VPS13B突变显著抑制了VPS13B与Sec23IP的互作,提示二者互作改变可能是潜在的致病因素。
VPS13蛋白可以在两个细胞器之间的膜接触位点架起桥梁,进行脂质转运,从而实现细胞器膜的生长扩张,促进细胞器的发生。研究发现,VPS13B缺失不会显著影响ERES、coatomer和 经典ERGIC的形态、丰度和分布,但会显著抑制一种新型的货物转运载体tubular ERGIC的形成。回补实验表明VPS13B以依赖转脂活性的方式促进这种新型的货物转运载体的发生。此外,以原代培养的小鼠MEF细胞作为研究体系,利用成像和组学分析发现,VPS13B和Sec23IP参与促进胶原蛋白前体从内质网向高尔基体转运,提示Cohen 综合征患者的关节过度屈伸可能与胶原蛋白分泌异常有关。
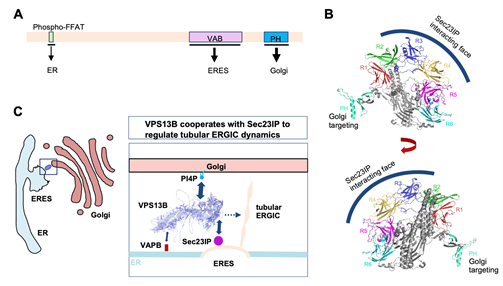
本研究鉴定了VPS13B的招募因子Sec23IP,解析了VPS13B定位及其分子机制,为解答学界长久关注的重要问题提供线索;揭示了VPS13B作为ER-to-Golgi转运的调控新因子,在机体发育过程中满足特定组织细胞(如神经、关节和精子等)对蛋白及膜脂高强度转运和分泌的需求。研究人员认为,VPS13B基因突变导致的货物转运异常(包括但不仅限于胶原蛋白)可能是Cohen综合征发病的潜在机制。尽管此研究提示VPS13B的转脂活性对于tubular ERGIC发生至关重要,二者之间的链接仍然欠缺,VPS13B转运脂质的作用机制有待阐明。VPS13B转运哪种膜脂分子?膜脂供体是什么?其是否与其他VPS13家族蛋白类似,通过搭桥方式转运脂质?这些问题需要后续的深入研究进行回答。总而言之,本研究为探索VPS13家族转脂蛋白突变相关罕见病的共性发病机制提供了新的视角和依据。
华中科技大学基础医学院在读博士杜元娇和樊新宇为该论文的第一作者,季维克教授为该论文的通讯作者。深圳湾实验室邓麟研究员在该项目的实施中给予了实质性帮助。本研究得到国家自然科学基金和深圳湾同舟学者项目的资助。
季维克团队长期从事细胞器相互作用及相关疾病发病机制研究,围绕“膜接触与脂转运”开展了系统性研究,取得了一系列创新性成果,鉴定了多个细胞器膜接触发生及调控的关键新因子,并揭示这些关键因子基因突变导致疾病的细胞生物学机制,为提炼转脂蛋白突变的共性发病机制提供理论基础。近5年研究工作以通讯或共同通讯作者在J Cell Biol(2023/2024)、Cell Discov(2024)、Cell Death Differ (2023)、Contact (2023)、J Cell Sci(2022)、Nat Comm (2021)、Mol Biol Cell(2021)等期刊。实验室诚聘细胞生物学、生物化学、免疫学和蛋白/脂质组学等方向博士后加入实验室。
 学院官方微信
学院官方微信