
2024年4月26日,华中科技大学同济医学院基础医学院郭峥教授课题组与湖南师范大学翟宗昭教授课题组合作在Nature communications杂志在线发表了题为“肠内分泌细胞通过感知 L-谷氨酸调节肠道PYY/NPF分泌来调控食物摄入量”(Dietary L-Glu Sensing by Enteroendocrine Cells Adjusts Food Intake via Modulating Gut PYY/NPF Secretion)的研究论文。该研究发现肠道内分泌细胞(enteroendocrine cells, EEC)感知食物中的L-谷氨酸后,降低自身钙震荡频率,减少PYY/NPF向体液中的分泌,解除位于肠道前端一对肠神经对进食的抑制,从而促进进食。
EEC可以直接感知食物中的营养物质并释放调节性神经肽。进食后,食物中的糖、氨基酸和游离脂肪酸等刺激小鼠和人十二指肠中EEC释放神经肽GLP-1、GIP和PYY,达到抑制食欲的作用。临床上,目前以利拉鲁肽和司美格鲁肽为代表的GLP-1受体激动剂药物在肥胖症和二型糖尿病的治疗上有着显著的疗效。然而,EEC感知营养调控神经肽释放的分子机制是怎样的? EEC释放的神经肽如何调控机体的生理反应?人们对这些问题仍知之甚少。此外,EEC和神经内分泌细胞表达许多相同的神经肽,那么不同器官表达的神经肽是否具有不同的生理功能?
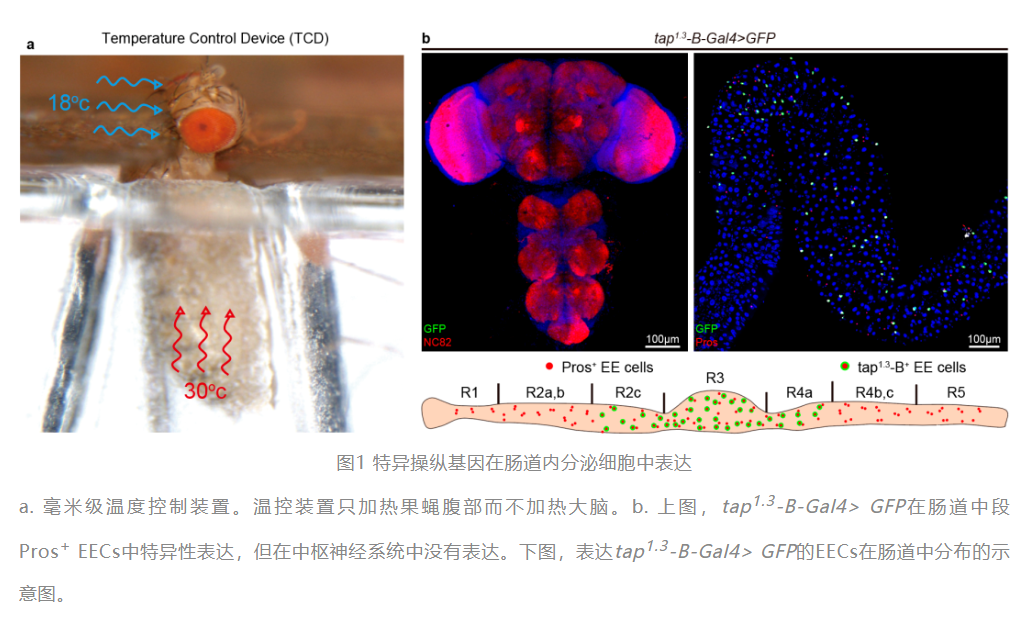
长久以来,由于EEC与神经内分泌细胞表达的相似性,人们一直缺少仅在EEC中进行基因操作的手段。目前已发表的多项研究,都难以排除神经系统对表型的影响。为了研究EEC的生理功能,研究人员首先通过遗传学手段和毫米级温度控制装置特异性去除了肠道中所有的EEC。研究人员发现缺失EEC后果蝇的进食量相较对照组有显著的上升,说明果蝇的EEC起到了抑制进食的作用。随后,利用该研究中构建的EEC特异的驱动子:tap1.3-B-Gal4,研究人员发现EEC分泌的神经肽F(neuropeptide F,NPF)抑制了果蝇的进食。此外,该研究还发现,神经元和EEC分泌的NPF在食欲调控方面发挥着截然相反的作用,EEC分泌的NPF不能替代神经元分泌的NPF的功能,反之亦然。
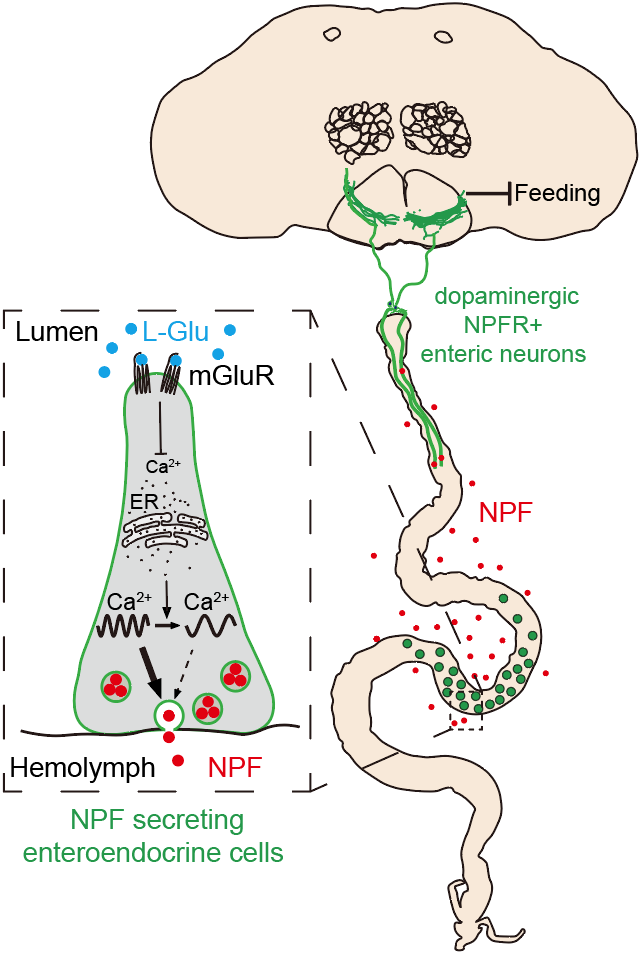
当给果蝇喂食高蛋白食物时,研究人员发现EEC中NPF的染色水平显著增强,暗示EEC在氨基酸感知中发挥着重要作用。通过分别给果蝇喂食含有单一氨基酸的食物,研究人员发现L-Glu(L-谷氨酸)喂食会引起的EEC中NPF染色水平的升高,并且这种升高是EEC分泌NPF水平下降所导致的。此外,研究人员通过活体成像的方法记录了经过不同喂食处理的、体外培养的果蝇肠道EEC中Ca2+信号的动态变化。数据表明,不同食物喂养下EEC中Ca2+信号的峰值没有显著性差异,然而L-Glu喂食显著降低了EEC中钙信号震荡的频率,从而抑制了NPF的分泌。随后,通过遗传筛选,研究人员发现mGluR是EEC感受食物中L-Glu、调节NPF分泌的受体。
接下来研究人员想知道从EEC分泌出来的NPF是如何抑制进食的。研究人员发现NPFR除了在中枢神经系统表达之外,还在肠神经中表达。通过筛选,研究人员发现GMR60E02-Gal4在脑下神经节的一对肠神经中表达。这对肠神经的胞体与成虫肠道的前胃区紧密相连,其树突向下延伸到肠道R1区域的肠壁,轴突向上连接到大脑中的进食调节中枢-食管下区域(subesophageal zone,SEZ),研究人员将这对肠神经命名为NPFRENS神经元。RNAi敲除和免疫染色结果表明NPFRENS神经元是一对多巴胺能神经元,通过NPFR感知EEC分泌的NPF,抑制果蝇的食欲。最后,通过顺向跨突触标记方法,研究人员发现位于大脑SEZ区域和触角神经叶区域的神经元可以与NPFRENS肠神经形成突触连接,其神经末梢形态和胞体位置提示某些运动神经元和中间神经元可能参与了NPFRENS神经元所介导的进食调控。
综上所述,该研究揭示了EEC通过感知氨基酸,调控细胞内钙震荡频率以控制神经肽释放的分子机制,并完整地解析了肠道释放的PYY/NPF通过肠-脑轴抑制食欲这一高度保守的作用机制。这些发现将有助于人们对于哺乳动物EECs营养感知过程基本原理的理解。同时也为理解代谢性疾病的发病机理提供了新的视角,为开发新的治疗方法提供了潜在靶点。在未来,我们有望通过小分子拮抗剂抑制EEC中mGluR的活性或操纵EEC中钙震荡的频率来调控EEC中神经肽的释放,从而治疗肥胖及二型糖尿病等代谢性疾病。
华中科技大学同济医学院基础医学院博士生高俊军为唯一第一作者。该工作得到了国家自然科学基金的支持。
原文链接:https://rdcu.be/dFLBQ

 学院官方微信
学院官方微信
