
2024年4月2日,华中科技大学基础医学院/细胞架构研究中心季维克课题组和深圳湾实验室邓麟课题组合作在Cell Discovery(IF=33.5)在线发表了题为“RhoBTB3-SHIP164-Vps26B 复合体调控早内吞体出芽结构的生物发生”(Biogenesis Biogenesis of Rab14-positive endosome buds at Golgi–endosome contacts by the RhoBTB3–SHIP164–Vps26B complex)的研究论文。该研究发现SHIP164定位于高尔基体-早期内吞体膜接触,与Retromer蛋白Vps26B和高尔基体蛋白RhoBTB3形成蛋白复合体,通过介导高尔基体与早期内吞体出芽结构之间的膜脂转运,调控早期内吞体膜脂组成,促进早期内吞体出芽过程中的膜扩张。
内吞分选作为细胞活动的基本过程之一,决定了内膜系统上众多蛋白的命运,从而影响多种重要的细胞过程,比如营养物质摄取、细胞信号转导、胞内离子稳态等,其调节紊乱和多种神经疾病、糖尿病、免疫性疾病密切相关。
早期内吞体是货物分选早期阶段的关键部位,运往质膜或高尔基体的货物首先被分选进入早期内吞体的特殊膜结构-出芽结构,然后通过膜分裂实现出芽结构与早期内吞体的分离,进一步通过循环途径返回质膜或高尔基体。另一方面,要被降解的货物则留在早期内吞体中,随着内吞体成熟,最终在溶酶体中降解。因此,出芽结构在货物分选中发挥关键作用。出芽结构是货物分选过程中在内吞体上从头发生的一种特化膜结构,其发生起始于货物接头复合体,如retromer或retriever,对不同回收货物进行识别富集,并招募出芽发生和分裂所必需的因子。其中,货物接头复合体结合WASH复合体,进而结合并激活Arp2/3,激活微丝聚合,在出芽结构上生成分支肌动蛋白结构,促进出芽结构形成和稳定、货物结合和分裂。目前,学界对出芽结构生物发生的分子机制仍未完全理解,出芽过程中膜脂获取的分子机制仍然未知。
VPS13是一种新型的转脂蛋白,具有高度保守的长疏水沟槽结构。通过与不同细胞器上的衔接蛋白相互作用,VPS13蛋白可以在两个细胞器之间的膜接触位点架起桥梁,进行脂质转运,从而实现细胞器膜的生长扩张,促进细胞器的发生。研究指出,VPS13家族蛋白ATG2定位于内质网-自噬体膜接触,通过将磷脂分子从内质网转运到自噬体,促进自噬体膜扩张,最终形成成熟自噬体;在酵母减数分裂过程中,Vps13蛋白利用转脂活性为孢子膜的发生提供脂质。因此VPS13蛋白在细胞器发生以及脂质稳态的维持方面具有重要的作用。
SHIP164具有特征性的长疏水沟槽结构,其结构与VPS13蛋白高度相似,属于VPS13家族。研究指出,SHIP164与Syntaxin-6存在相互作用,可能在早期/循环内吞体到高尔基体的货物运输过程中起作用。临床研究表明,SHIP164是帕金森病的重要风险因子,其突变与该重大疾病直接相关。目前学界对于SHIP164的定位、精确细胞功能场景及其分子机制尚不明确,因此也缺乏对SHIP164突变致病的理解。
在本项工作中,研究人员首先利用小GTPase文库结合高通量活细胞成像进行筛选,鉴定了SHIP164互作蛋白RhoBTB3。RhoBTB3是一种ATPase,在高尔基体-内吞体转运过程中起作用。生化实验表明,SHIP164 N末端的Chorein N domain结合RhoBTB3。另一方面,通过体外pull-down结合质谱分析,鉴定了SHIP164 C末端的互作蛋白Vps26B。Vps26B是Retromer复合体的组分,参与早期内吞体货物的分选及出芽结构的发生。Vps26B的同源蛋白Vps26A并不与SHIP164互作,提示SHIP164与Vps26B互作高度特异。
随后,研究人员通过对细胞内不同Rab标记的内吞体进行筛选发现,敲除SHIP164会特异性影响Rab14标记的内吞体的大小和数量。Rab14定位于早期内吞体及相关膜转运载体,作用于货物从内吞体向高尔基体转运。生化实验表明Vps26B是Rab14的效应因子,Rab14的活性同时调控Vps26B和SHIP164向早期内吞体的招募。研究人员通过高分辨率成像发现,敲除SHIP164会抑制出芽结构的形成。功能回补实验表明,野生型SHIP164能够有效逆转SHIP164敲除导致的出芽异常,但是脂转移活性缺失的突变体却无法逆转该表型,表明SHIP164介导膜脂转运调控早期内吞体出芽。
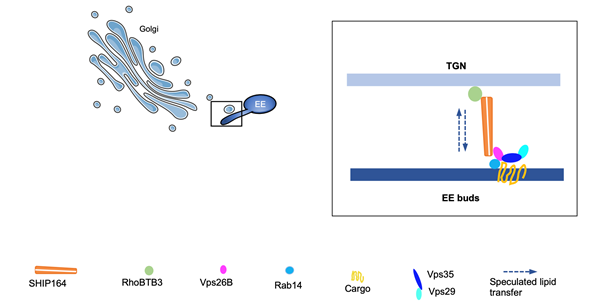
根据以上结果,研究人员提出了一个工作模型。Retromer蛋白Vps26B是Rab14效应子,激活的Rab14将Vps26B招募到潜在的早期内吞体出芽位点,然后Vps26B招募SHIP164。当早期内吞体与高尔基体形成动态接触时,SHIP164、Vps26B和RhoBTB3在接触位点形成Vps26B-SHIP164-RhoBTB3复合物。SHIP164介导磷脂在高尔基体和早期内吞体之间的转运,调控二者的膜脂组成,从而促进早期内吞体出芽的形成,确保货物的精确分选和转运。目前学界认为内质网与内吞体的膜接触对于内吞体动态及出芽结构与内吞体的分离步骤发挥关键作用。这项工作首次发现高尔基体在内吞体出芽发生中发挥重要作用,揭示了膜接触/脂转运调控货物分选的新模式,拓展了学科前沿,为后续VPS13蛋白相关研究提供了新的方向。因为SHIP164与帕金森等疾病密切相关,这项研究也为探索这类重大疾病发病机制提供了新的切入点。
华中科技大学基础医学院博士毕业生王静茹(目前就职于空军军医大学唐都医院)和华中科技大学同济医学院附属同济医院麻醉科熊娟为该论文的第一作者,季维克教授和邓麟研究员为该论文的通讯作者。该工作得到国家自然科学基金、科技部和深圳湾同舟学者项目资助。
文章链接:https://www.nature.com/articles/s41421-024-00651-6
 学院官方微信
学院官方微信