5月13日,国际知名杂志EMBO Rep(影响因子8.749)在线刊发了基础医学院病理生理学系刘恭平教授、王建枝教授团队研究成果:Tau accumulation triggers STAT1-dependent memory deficits by suppressing NMDA receptor expression.
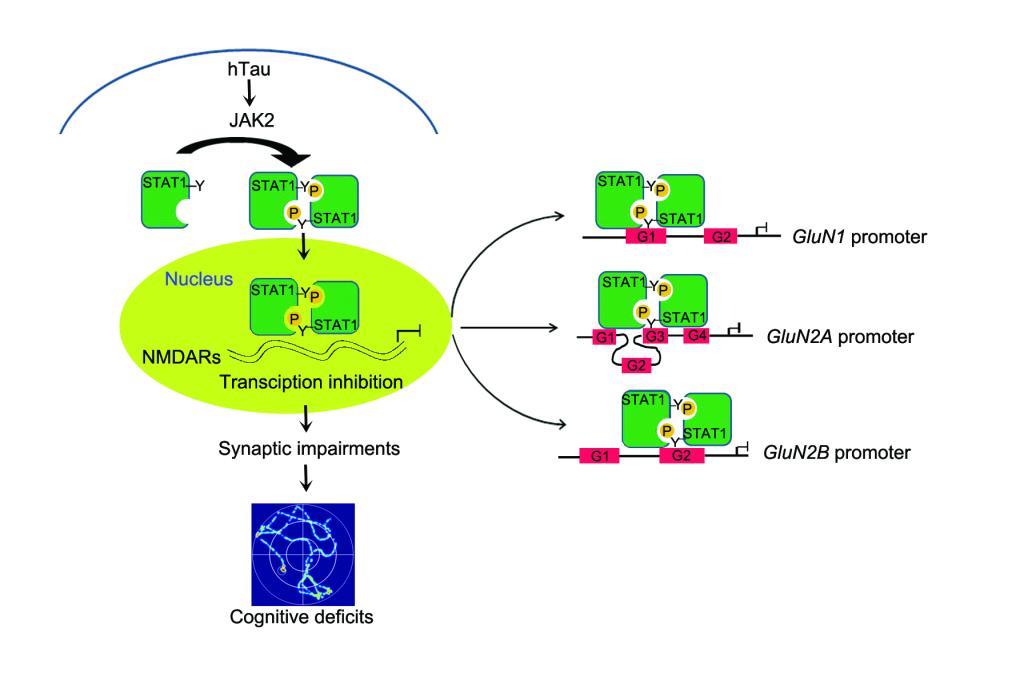
阿尔茨海默病(Alzheimer’s disease,AD)是老年人中最常见的神经系统退行性疾病,现今无有效的诊断与治疗手段。AD典型的病理学特征之一是Tau蛋白异常聚集形成的神经原纤维缠结。大量研究表明Tau蛋白异常聚集可以诱发突触毒性,但其分子机制并不清楚。王建枝、刘恭平教授团队在过表达人全长tau(hTau)蛋白的细胞中,发现520种mRNA水平有显著性变化;同时在转录因子活性筛查中发现STAT1转录活性显著上调。于hTau转基因鼠、过表达AAV-hTau病毒小鼠及AD患者脑组织均发现STAT1的激活;而STAT1的条件性敲除能显著性逆转hTau诱发突触相关蛋白NMDARs的转录抑制和学习记忆障碍。染色质免疫共沉淀发现STAT1能直接结合NMDARs启动子区;荧光素报告基因发现STAT1对NMDARs有转录抑制作用;并发现hTau聚积可激活JAK2,而后者介导了STAT1的磷酸化水平升高与活化。使用STAT1-Y701F失活突变病毒可抑制STAT1激活,逆转hTau诱发的突触毒性作用。该研究发现了htau聚积通过激活JAK2-STAT1通路,抑制NMDARs转录,从而使突触可塑性下降,导致学习记忆损伤。这一研究结果揭示了AD新的发病机制,可望为AD药物开发提供新的靶标。
该研究由博士研究生李晓光、洪小月等共同完成。李晓光(王建枝教授2012级直博生)、洪小月(刘恭平教授2016级博士生)为该文的共同第一作者,刘恭平教授、王建枝教授为共同通讯作者,华中科技大学为第一发表单位。该课题受到国家自然科学基金面上项目、重点项目以及科技部国家重点研发计划慢病专项等资助。
文章在线链接:
http://embor.embopress.org/content/early/2019/05/13/embr.201847202.long
 学院官方微信
学院官方微信