糖、脂、蛋白质三大物质的代谢是一切生命活动的基础,但同时不可避免地产生危害生命的物质。糖、脂代谢在产生能量的同时,会形成有害的自由基,而蛋白质的分解代谢则释放慢性细胞毒分子氨(NH3)。各个组织器官的细胞均有强大抗氧化(清除自由基)的功能,这一方向已被广泛研究,但对于氨的清除,除了已知的肝细胞将NH3转化为尿素解毒外,对其研究非常稀少。2022年12月6日,国际免疫学杂志《自然·免疫学》(Nature Immunology)在线发表了我校基础医学院黄波教授课题组最新研究论文“Ammonia detoxification promotes CD8+ T cell memory development by urea and citrulline cycles”,本项研究揭示尿素循环代谢对于维持记忆性T细胞的发育和长期存活具有重要意义,从全新的代谢途径解释了T细胞记忆形成这一基本的免疫学问题。
记忆性T(Tm)细胞属于一类典型的长寿命细胞,其能在机体内存活数月至数年乃至终生,记忆性T细胞形成与维持是疫苗保护、肿瘤免疫治疗、机体抗病毒感染的基础。如何从根源上解析记忆性T细胞维持长寿命的原因,依然是困扰免疫学家的一大难题。黄波课题组长期致力于揭示记忆性T细胞维持长寿命的关键代谢特征,2018年课题组发现记忆性T细胞的长期存活与糖异生-糖原代谢这种独特的代谢模式有关,Tm通过高表达糖异生途径的关键限速酶磷酸烯醇式丙酮酸羧激酶PCK1而促进糖原的合成,又通过磷酸戊糖途径产生还原型NADPH,维持高水平的还原性谷胱甘肽,及时清除胞内的氧自由基,从而维持记忆性T 细胞的长期存活。Tm由效应性T细胞衍生而来,二者为何PCK1的表达发生差异?该课题组继续深入研究,发现记忆性T细胞中存在酮体代谢,与常规认为酮体的能量供应不同的是,Tm中酮体代谢通过β-羟基丁酸促进组蛋白的表观遗传修饰介导PCK1的高表达,在记忆性T细胞的功能维持和长期存活中发挥重要作用,相关研究成果相继在2018和2020年发表于国际细胞生物学杂志《自然·细胞生物学》(Nat Cell Biol. 2018;20:21-27;Nat Cell Biol. 2020;22:18-25)。
众所周知,细胞需要利用能量分子ATP维持生命活动。葡萄糖和脂肪酸氧化是生成ATP的主要来源。此外,氨基酸在脱氨基后也可以被氧化以提供或调节能量生成。然而,在细胞产生ATP的过程中,作为副产物的活性氧(ROS)和氨(NH3)也不可避免地产生,且这两种物质都具有细胞毒性,损害细胞寿命。因此,长寿细胞必须利用高效的机制来清除ROS和氨以延长存活时间。
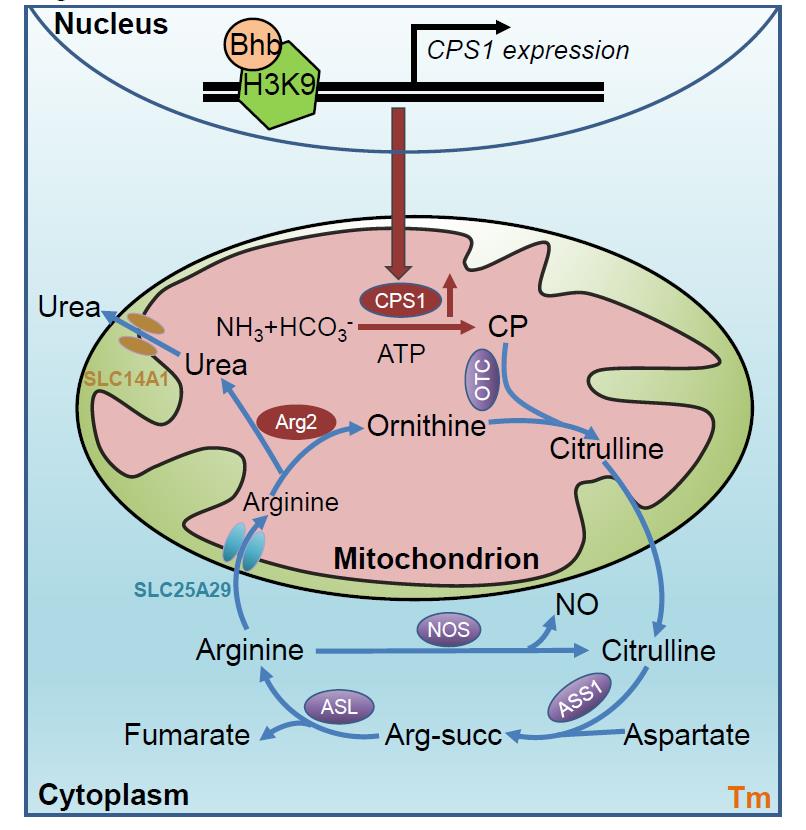
在前面的研究中,课题组已经揭示了记忆T细胞如何清除ROS,但是CD8+ Tm细胞是否能通过代谢清除有毒的氨仍然是未解之谜。氨基酸的脱氨基是细胞内氨的主要来源,主要通过两个步骤:第一步是转氨基作用介导的谷氨酸或谷氨酰胺的生成,第二步则是谷氨酸或谷氨酰胺的脱氨基作用生成。一般认为,氨在肝脏中通过尿素循环进行处理,肝细胞从外周循环中吸收氨,并使用氨基甲酰磷酸合成酶-1(CPS1)催化氨和碳酸氢盐(HCO3-),在线粒体中形成氨基甲酰磷酸(CP)。然后, CP与鸟氨酸反应,通过鸟氨酸氨基甲酰磷酸转移酶(OTC)生成瓜氨酸。瓜氨酸之后进入胞浆,通过精氨酸琥珀酸合成酶1(ASS1)与天冬氨酸结合生成精氨酸,然后精氨酸裂解酶(ASL)将其代谢为精氨酸和延胡索酸最终精氨酸酶1(ARG1)将精氨酸水解为鸟氨酸和尿素,最后鸟氨酸进入线粒体形成循环。传统观念认为尿素循环只发生在肝脏,但课题组通过构建特异性抗原记忆性T细胞体内过继模型、同位素示踪技术和超高分辨液相质谱联用等方法首次证明了尿素循环存在于记忆T细胞中并发挥重要功能,并通过一系列动物模型和体外机制分析验证了尿素循环对Tm细胞记忆维持是必须的;在后续的研究中作者进一步发现与传统的尿素循环通过精氨酸酶1产生尿素不同的是,CD8+ Tm细胞利用定位于线粒体的精氨酸酶2催化精氨酸生成尿素,并进一步研究了精氨酸和尿素分别通过SLC25A29和SLC14A1两种溶质蛋白转运体进出线粒体;深入的机制研究还发现,除了尿素循环外,CD8+ Tm细胞还利用瓜氨酸循环进行解氨作用,与尿素循环联合发挥作用;此外,作者利用多种动物模型验证了尿素循环关键酶Cps1的基因表达对Tm细胞氨处理和记忆维持至关重要并利用表观遗传学手段发现Cps1转录启动子区域β-羟基丁酰化是诱发Cps1表达的关键。最后在体内肿瘤治疗模型中,Cps1高表达的Tm细胞也显示出更高效的抗肿瘤功能,为T细胞回输的免疫治疗提供了全新的代谢调控思路,有着明确的临床转化意义。本项研究的发现将使我们从全新的代谢角度阐明Tm细胞长期存活的机制,并将提供一种全新的T细胞抗肿瘤思路和转化手段。
本研究工作得到了国家自然科学基金(81788101,82071864,82150103)和中国医学科学院医学与健康科技创新工程项目(2021-I2M-1-021)的支持。基础医学院生物化学与分子生物学系唐科副教授为论文第一作者,病理学系张华锋副教授和生化系2020级博士邓经辉为本论文共同第一作者。黄波教授为论文通讯作者,华中科技大学基础医学院为论文第一和通讯单位。
相关论文信息(DOI): 10.1038/s41590-022-01365-1
 学院官方微信
学院官方微信